
이 기사는 역사상 가장 크고 충격적인 폭발 사고가 일어난 베이루트 참사를 추모하기 위한 취지로 작성되었습니다. 이 사고는 200km 떨어진 키프로스에서도 폭발음이 들릴 정도의 엄청난 규모였습니다. 폭발의 진원지는 항만 창고 시설로, 2,750톤의 질산암모늄 연료가 원인이었습니다.
질산암모늄은 가장 널리 사용되는 비료 중 하나로, 탄광 폭약과 같은 다른 많은 탄광 폭약의 중요 성분이기도 합니다. 항생물질과 이스트를 만들기 위한 영양분으로도 사용됩니다. 산업 공정에서 사용되는 다른 많은 화학 물질과 마찬가지로 안전한 보관과 엄격한 취급 절차를 통해 그 위험성을 완화시킬 수 있습니다.
베이루트 폭발 사고에 대한 조사는 현재도 계속 진행 중이지만 항만 창고에서 시작된 불이 질산암모늄이 보관된 장소로 확산된 것으로 알려져 있습니다. 별도의 격리 또는 화재 예방 조치 없이 불꽃 근처에 인화 물질을 부주의하게 보관한 것이 폭발의 원인이었습니다. 이 사고로 순식간에 200명의 사망자, 5,000명이 넘는 부상자와 함께 약 300,000명의 이재민이 발생했습니다. 유감스럽게도 이 사고는 유일무이한 특별한 케이스가 아닙니다. 질산암모늄과 같은 화학 물질로 인한 폭발과 화재는 너무나도 흔하게 일어나고 있습니다. 궁극적으로 물질이 에너지를 빠르게 방출하면 폭발 또는 화재 위험이 수반됩니다. 그렇다면 특정 화학 물질이 이러한 특성을 갖는 이유는 무엇일까요?
약한 화학 결합과 안정적인 생성물이 만나 폭발력을 발휘합니다.
물질의 화학 결합이 약할 경우, 특히 그 생성물이 안정적이면 화재나 폭발의 위험이 있습니다. 가솔린과 같은 연료는 연소 시 화학 결합이 강력하고 상태가 안정적인 물질이 생성됩니다. 가솔린의 경우 이러한 생성물은 이산화탄소와 물입니다. 가솔린은 열 또는 불꽃이나 불길과 같은 발화원이 있어야 연소됩니다. 연료 반응 물질의 결합이 쉽게 풀리지 않기 때문입니다.
예를 들어 그림 1은 가솔린 연소와 같은 반응의 개념 모델을 보여줍니다. 보라색 선은 반응 물질에서 생성물로의 반응 과정에서 자유 에너지의 변화 상태를 나타냅니다. 가솔린이 연소되면 물과 이산화탄소와 같은 강한 결합의 안정적인 생성물이 만들어지며 그 과정에서 엄청난 양의 에너지가 발산됩니다. 그림의 왼쪽 시작점에서 오른쪽 반응 끝까지 높이가 다르게 나타나는 이유입니다. 반응 물질과 생성물 사이의 자유 에너지 차이가 증가하면서 반응 발생 시 방출될 수 있는 에너지의 양 또한 증가합니다.
그런데 반응 물질에서 생성물을 얻기 위해서는 분자가 반응을 시작할 수 있는 충분한 에너지가 분자에 있어야 합니다. 반응은 일반적으로 결합의 해체로 시작되며 강한 결합을 해체하려면 엄청난 양의 에너지가 필요합니다. 즉 안정적인 분자의 반응을 시작하려면 많은 양의 에너지가 필요합니다. 이 에너지를 활성화 장벽이라고 하며 반응 경로 중앙에서 높이 솟은 부분의 높이로 알 수 있습니다.
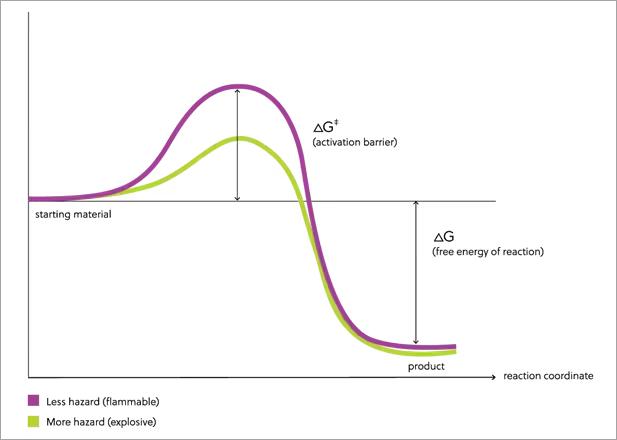
활성화 장벽을 넘으면 반응이 발생할 수 있습니다. 반응 물질과 생성물의 자유 에너지 차이가 큰 만큼 한 분자의 반응이 다른 분자가 활성화 장벽을 넘을 수 있는 충분한 에너지를 제공할 수 있습니다. 반응이 계속해서 가속화되면 반응 물질을 모두 소비할 때까지 멈추기가 어렵습니다. 가솔린으로 시작된 화재 역시 쉽게 끄기 어렵습니다. 또한 생성물은 가스이므로(이산화탄소와 증기) 반응 물질보다 훨씬 더 넓은 공간을 차지합니다. 부피 확장에 따라 주변으로 에너지가 전달되므로 밀폐된 공간에서 반응이 발생하면 폭발의 위험이 있습니다. 가솔린 연소에는 더 많은 에너지가 필요하므로 에너지를 제공하는 작용은 물론 화재 또한 보다 쉽게 예방할 수 있습니다.
폭발성 화학 물질 예를 보려면 여기를 클릭하고 추가 화학 안전 또는 물질 리소스를 보려면 화학 안전 라이브러리와 CAS Common Chemistry를 참조하십시오.
위험이 더 큰 다른 물질도 있습니다. 이러한 물질은 대부분 화학 결합 구조가 약합니다. 그림 1(녹색 선)은 또한 약한 결합 구조의 분자 연소와 같은 반응의 모델을 보여줍니다. 가솔린과 마찬가지로, 왼쪽 반응 물질과 오른쪽 생성물 사이의 자유 에너지 차이가 큽니다(높이 차이로 표시). 생성물은 강한 결합 구조를 가지며 반응 시 많은 양의 에너지가 방출됩니다. 그러나 이 반응의 경우 활성화 장벽의 높이가 가솔린 연소보다 훨씬 더 낮습니다.
반응은 일반적으로 결합의 해체로 시작되므로 약한 결합 구조는 반응이 쉽게 시작될 수 있습니다. 결합이 해체되면 완전히 연소될 때까지 반응이 이어집니다. 이 경우처럼 생성물의 에너지가 반응 물질보다 훨씬 더 적으면 한 분자의 반응으로 다른 분자의 반응을 유발하는 에너지가 방출될 수 있습니다. 반응 장벽이 낮으므로 그림 1 물질의 한 분자의 반응(녹색)에서 그림 1 물질의 한 분자의 반응(보라색)보다 더 많은 분자가 유도될 수 있습니다. 약한 결합은 반응이 시작되면 빠른 속도로 가속화될 수 있음을 의미합니다. 생성물이 가스인 경우 주변으로 확산되고 반응 속도가 충분히 빠르면 폭발이 발생할 수 있습니다. 약한 결합 물질의 반응 장벽이 낮다는 것은 반응을 시작하는 데 필요한 에너지가 적다는 것을 의미하므로 취급 방법이 보다 제한적입니다. 경우에 따라 취급 시 충격, 마찰 또는 불꽃으로 반응이 시작될 수 있으므로 이러한 물질은 화재나 폭발 방지를 위해 취급 시 훨씬 더 큰 주의가 필요합니다.
그 완벽한 예가 바로 아자이드화물(RN3)입니다. 이 물질은 3개의 연결된 질소 원자가 다른 강도의 결합 구조를 갖고 있습니다. 질소 원자는 강한 결합 구조를 가질 수 있습니다. 질소 가스 분자(N2)의 질소 원자 간 3중 결합은 알려진 가장 강력한 화학 결합 중 하나입니다. 그러나 질소 원자는 훨씬 더 약하지만 단일 결합 또는 2중 결합 구조를 가질 수도 있습니다. 아자이드화물의 질소-질소 결합 중 하나는 약한 결합이므로 해체에 많은 에너지가 필요하지 않아 빠른 분해와 함께 N₂가 생성됩니다. N2의 질소-질소 결합은 아지드화물 반응 물질의 질소-질소 결합보다 훨씬 더 안정적이므로 이러한 분해로 많은 에너지가 방출됩니다.
무기 아자이드화물과 유기 아자이드화물은 감도가 다릅니다. 무기 아자이드화 나트륨은 일상적인 상태에서 안전하게 취급할 수 있지만 차량 에어백에서는 가스를 빠르게 발생시킵니다. 또한 아자이드화납과 같은 고휘발성 중금속 아지드는 폭발물 뇌관으로 사용됩니다. 유기 아자이드화물은 일반적으로 제약품, 중합체 등 보다 복잡한 화학 물질을 합성할 때 사용됩니다. 분자량이 작거나 질소(N) 대 탄소(C) 원자 비율이 높은 유기 아지드화물은 폭발성이 있으며 무기 아지드화물과 디클로로메탄 간 반응에 따른 저분자량 아자이드화물 형성으로 인한 실험실 폭발 사고가 여러 건 보고되었습니다. 변형된 단백질 준비에 사용되는 아자이드화물 변형 아미노산 또한 폭발성이 있는 것으로 알려져 있습니다.
과산화물(ROOR)은 폭발 가능성이 있는 또 다른 유형의 분자입니다. 과산화물은 약한 산소-산소 결합 구조로, 결합이 해체되면 화학 반응에 유용한 라디칼 중합체(자유 라디칼)가 생성됩니다. 라디칼 중합체는 중합 반응의 기폭제로 특히 유용하며 일반적으로 연소 과정에서 중합체로 발견됩니다. 소량의 라디칼만으로 촉매제 역할을 할 수 있으며 경우에 따라 라디칼 자체 형성의 촉매제 역할을 하기도 합니다. 또한 과산화물은 분해 과정에서 산소 분자(O₂)를 생성합니다. 산소-산소 단일 결합은 약하지만 O2의 산소-산소 2중 결합은 강력하므로 이 분해 과정에서 에너지가 방출됩니다.
산소-산소 간 약한 결합은 과산화물이 쉽게 분해될 수 있음을 의미하며 결과적으로 자유 라디칼과 산소 방출로 인해 특히 농축된 상태에서 휘발성과 폭발성을 갖게 됩니다. 과산화물을 취급하는 화학 시설에서 큰 화재 사고가 여러 차례 발생한 바 있습니다. 허리케인 하비와 유례 없는 홍수로 안전 메커니즘이 붕괴된 미국 텍사스의 사례도 그중 하나입니다. 과산화물은 에테르가 산소에 노출될 때 자연스럽게 생성될 수도 있습니다. 이러한 과산화물은 결정체를 이루며 물리적 충격, 마찰 또는 특정 금속과 반응하면 폭발을 일으킬 수 있습니다. 에테르는 일반적으로 BHT(방부제로 사용되는 부틸히드록시톨루엔)와 같이 과산화물 형성을 방지하는 소량의 억제제로도 만들어집니다. 이러한 억제제는 산소와 반응하며 에테르를 장시간 산소가 있는 곳에 보관하면 과산화물이 만들어질 수 있습니다.
물질 안정성과 화재
자체적으로는 쉽게 분해되지 않지만 특정 조건에서 쉽게 반응하여 훨씬 더 안정적인 생성물을 만들 수 있는 결합 구조를 갖는 다른 물질도 있습니다. 새로운 결합이 만들어지면 에너지가 방출되어 열, 불 또는 폭발로 이어질 수 있습니다. 예를 들어 금속 알킬은 다양한 화학 물질와 일반 물질의 합성 과정에서 촉매제로 사용되지만 자연 발화되는 경우가 많아 공기와 접촉 시 쉽게 화재를 일으킬 수 있습니다.
특히 트리메틸알루미늄은 공기 또는 물과 반응하여 매우 안정적인 알루미늄-산소 결합의 생성물을 만들어내며 결과적으로 화재와 폭발을 일으킵니다.
아크릴산염은 공업용 중합 용도로 사용됩니다. 각각의 아크릴레이트 모노머가 고분자 사슬에 통합될 때 2중 결합을 추가 단일 결합으로 바꿉니다. 이 새로운 결합은 2중 결합의 누적 강도보다 강력하므로 중합 반응으로 에너지가 방출됩니다. 아크릴산염과 다른 알켄의 중합은 중합 반응을 일으키기 위해 과산화물과 같은 라디칼 개시제를 사용하는 경우가 많으며 그 반응성으로 인해 다른 환경에서도 폭발을 일으킬 수 있습니다. 대규모 중합 챔버에서 표면 면적 대 부피의 비율이 형성된 열을 분산시키기에는 너무 낮으며, 통제되지 않는 중합 반응의 억제제가 전소, 비활성화 또는 제거되면 아크릴산염이 중합 과정에서 폭발할 수 있습니다.
마찬가지로 다이메틸설폭시화물(DMSO)과 같은 솔벤트는 산, 염기, 친전자체와 같은 다양한 물질과 반응하여 분해 온도를 낮출 수 있습니다. 안전해 보이는 더 낮은 온도에서 반응이 일어나더라도 폭발을 일으킬 수 있습니다.
현대 사회를 움직이는 중요한 원동력
화학은 에너지 변화가 그 기본 원리입니다. 인간은 수세기 동안 이 에너지를 이용하여 전세계를 여행하고 산업을 움직이고 의식주를 영위하는 데 도움을 받아왔습니다. 인간은 에너지를 얻기 위해 폭발성과 휘발성이 있는 화학 물질을 필요로 하지만 그 위력으로 예상치 못한 충격적인 결과를 맞이할 수 있습니다. 이 에너지를 건설적인 방법으로 활용하고 화학 물질이 예상치 못한 위험한 결과를 초래할 수 있는 조건을 정확하게 파악해 폭발 사고를 사전에 인지하고 예방할 수 있습니다.
질산암모늄과 그 위험성, 안전 규정에 대한 자세한 정보가 필요하면 CAS Insights 보고서 전문을 다운로드하거나 다양한 물질 형성 방법과 혁신 동향에 대한 주요 전문가의 의견을 들어볼 수 있는 CAS 웨비나를 시청하십시오.
Gain new perspectives for faster progress directly to your inbox.




